May 3, 2017 | Matteo M.
Perché i coralli crescano al meglio, molte condizioni chimiche e fisiche devono essere ottimali. Dana Riddle ha pubblicato su Advanced Aquarist un interessantissimo articolo in cui esamina gli effetti di vari livelli di bicarbonati disciolti sulla fotosintesi e sulla crescita corallina, che cercherò qui di illustrarvi brevemente nelle parti più interessanti.
Per i più curiosi l’articolo completo (in inglese) è reperibile a questo indirizzo.
La fotosintesi è il legame tra il mondo dell’inorganico e quello dell’organico e l’importanza dell’attività delle zooxanthellae nel mantenimento della salute dei coralli fotosintetici è ormai cosa assodata.
L’attività della fotosintesi dipende dalla quantità di luce, dalla sua qualità spettrale e da una fonte di nutrienti (per le piante terrestri, per fare un esempio più facilmente intuibile, la ” fonte di nutrienti” è generalmente definita come azoto, potassio e fosforo con “micronutrienti” descritti come ferro , rame e molte altri). Sebbene non elencato come fonte, il carbonio inorganico (sotto forma di anidride carbonica) è un importante nutrimento in quanto è necessario per la crescita vegetale e la produzione di zucchero semplice.
Nell’acquario marino, sostanze nutritive come l’azoto e il fosforo sono di solito disponibili in tale abbondanza che spesso risulta necessario adoperarsi per eliminarli. Il potassio, con una concentrazione di circa 400 mg / L, è anche una buona fonte di nutrienti, inoltre
molti micronutrienti potrebbero essere aggiunti o ricostituiti attraverso l’alimentazione o i normali cambi d’acqua.

Ma quale è invece la situazione del carbonio? Se è comunque vero che una certa quantità
di anidride carbonica può essere presente in un acquario e quindi questa può soddisfare una parte della domanda di carbonio necessario fotosintesi delle zooxanthellae, vi sono evidenze che in molti casi una altra frazione di carbonio utilizzato da alcune zooxanthellae verrà fornito dal bicarbonato disciolto nell’acqua dell’acquario.
La legge di Liebig afferma che la fotosintesi è controllata non dalla concentrazione della sostanza nutritiva più abbondante, ma dalla disponibilità di quella più carente – che quindi definirà il tasso di fotosintesi. Questo fatto è ben riconosciuto dagli appassionati di piante d’acqua dolce e infatti le aggiunte nutrizionali sono fatte normalmente per prevenire la malattia generale delle piante nota come clorosi.
Gli acquari marini di barriera dovrebbero essere monitorati regolarmente per il valore di alcalinità perché è importante per diversi motivi.
Per dare una semplice definizione, l’alcalinità è la capacità di una soluzione di neutralizzare gli acidi. L’alcalinità può essere misurata in diversi modi (meq / L, ppm, mg / L come carbonato di calcio – CaCO 3 ) ma il grado di durezza carbonatica (dKH) la più utilizzata come standard in acquariofilia.
L’alcalinità quindi agisce come un tampone contro spostamenti verso il basso del pH, il che è molto importante poiché il processo di nitrificazione che normalmente avviene in acquario lo abbassa. Carbonati e calcio sono anche essenziali nella formazione delle strutture (scheletri) dei coralli duri.
Ma che importanza ha l’alcalinità rispetto ad essere una fonte di carbonio inorganica per la fotosintesi? Per rispondere a questa domanda, sono stati condotti vari esperimenti, per verificare l’ipotesi che le concentrazioni di carbonati potessero influenzare l’attività di fotosintesi.
L’attività fotosintetica è quantificabile attraverso il parametro “rETR” cioè come “rateo di trasporto elettronico relativo”. Il rateo di trasporto elettronico (ETR) è una misura dell’attività di fotosintesi. Le particelle leggere (fotoni) una volta assorbite dai fotopigmenti (es. clorofilla) diventano elettroni e fluiscono (normalmente) tra i fotosistemi.

Un basso ETR significa un basso tasso di fotosintesi; Un alto ETR significa un tasso elevato. Se si misura l’assorbimento della luce, il flusso di elettroni viene chiamato ETR. Altrimenti, viene indicato come il tasso di trasporto elettronico relativo o rETR.
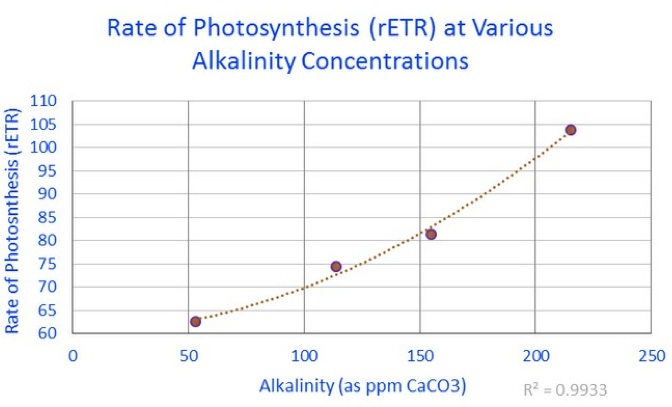
Per chiarezza, 53 ppm = 2.968 dKH; 114 = 6.384; 155 = 8.68 and 215 = 12.04
Il grafico precedente riporta le misure di rETR legato all’attività delle zooxanthellae all’interno di un corallo “porites lobata” alle varie concentrazioni di alcalinità, in ambiente sperimentale.
Il risultato di questi esperimenti ha dimostrato che il tasso di fotosintesi potrebbe essere aumentato di circa il 29% aumentando l’alcalinità da un livello “normale” (6.4 dKH) ad un livello elevato (12 dKH).
L’importanza dei carbonati come fonte di carbonio inorganico per la fotosintesi potrebbe sorprendere: anche se pensiamo ai coralli come creature relativamente semplici, la biochimica coinvolta nei loro processi di vita può essere qualsiasi cosa, ma non semplice. Del resto ci sono svariate analogie con il metabolismo degli altri animali e quindi dell’uomo.

L’utilizzo di bicarbonato (HCO3-) come sorgente di carbonio inorganico per lafotosintesi coinvolge principalmente due attori: un enzima, l’anidrasi carbonica (interna ed esterna) e il “trasporto bicarbonato attivo”.
E’ infatti rilevato nel tessuto dei coralli un enzima, la carbonato deidratasi (o anidrasi carbonica; CAH o CA in inglese) che è presente anche nei globuli rossi e nei mesofilli delle piante, il cui compito è quello di catalizzare la reazione tra anidride carbonica (CO2) e acqua (H2O) a dare acido carbonico (H2CO3) e la reazione inversa, da acido carbonico ad acqua e anidride carbonica, secondo l’equazione chimica:
HCO3- + H+ ↔ CO2 + H2O
La direzione in cui la reazione ha luogo dipende dalla concentrazione di CO2: se questa è bassa (come per esempio nei nostri polmoni) l’acido viene dissociato, e viene liberata anidride carbonica; se questa è elevata, l’anidride si lega all’acqua che forma i carbonati e questi vengono poi trasportati nei tessuti (o nel nostro caso dal sangue ai polmoni). Per approfondire.
Come possiamo intuire, questo enzima potrebbe essere utile in entrambi i processi utili al corallo: fotosintesi delle zooxanthellae e la calcificazione dello scheletro.
Il carbonato non passa però facilmente attraverso le pareti delle cellule, bensì lo puòfare l’anidride carbonica. Quindi un CA esterno può trasformare il bicarbonato in anidride carbonica per consentirne un facile passaggio. Una volta all’interno della cellula, il CA riconverte l’anidride carbonica in bicarbonato per prevenirne la diffusione.
L’altro processo, il trasporto attivo di bicarbonato (BAT), sposta selettivamente il bicarbonato attraverso una membrana cellulare che è normalmente semipermeabile. A volte il BAT è chiamato pompa bicarbonato, questo processo può spostare ioni bicarbonato contro gradiente.

Il trasporto attivo di bicarbonato (BAT) porta il bicarbonato attraverso il mesoglea dove è ancora una volta convertito in anidride carbonica dal CA. L’anidride carbonica quindi diventa disponibile e viene utilizzata dalle zooxanthellae.
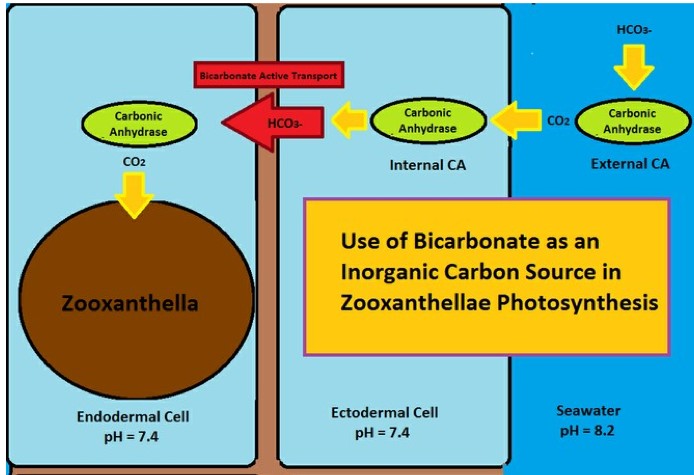
L’enzima anidrasi carbonica esterno (in alto a destra) è effettivamente attaccato alla parete ectodermica del corallo, cosa che questo disegno non riflette esattamente.
Se questo esperimento ha scoperto che il rateo di fotosintesi nel “porites lobata” potrebbe essere influenzato dalla concentrazione di ioni bicarbonato, ci sono prove che tale non è in altre specie di coralli.
In altri studi si è indagato sulle le preferenze di carbonio inorganiche di due famiglie zooxanthellae diverse e si è scoperto che differivano: alcune zooxanthellae
preferiscono prendere e fissare anidride carbonica, mentre altre potrebbero utilizzare anche bicarbonato.
Quindi, non possono essere fatte generalizzazioni a priori sul grado di utilizzo del bicarbonato da parte delle zooxanthellae.
Una conclusione più interessante potrebbe essere quella che alcuni coralli potrebbero non possedere molti (o nessun) enzimi di anidrasi carbonica (CA) esterna. Quindi, la loro dipendenza dall’anidride carbonica respirata potrebbe essere molto maggiore di quei coralli che invece hanno CA esterna. Quindi ne consegue che i tassi di crescita del corallo senza CA potrebbero essere più bassi di quelli con la capacità di utilizzare bicarbonato come fonte di carbonio alternativa.

Che rapporto esiste quindi tra bruciature da alcalinità alta (Alkalinity Burn) e l’aumento dell’attività fotosintetica? ‘Alkalinity Burn’ è un termine coniato in acquariofilia marina per indicare per la perdita dei tessuti di solito nella “punta” o, nel caso di Acroporidi, i polipi assiali apicali e vicini.
È possibile che le concentrazioni di clorofilla in determinate aree e i sottoprodotti della fotosintesi come il perossido di idrogeno e i radicali di ossigeno, sovrastino le difese naturali offerte dagli enzimi come perossidasi e catalasi?
Come più volte si è potuto notare in questi casi la bruciatura della punte è prevalente nelle zone che ricevono luce più intensa, quindi un elevato livello di bicarbonato potrebbe turbare la fotosintesi, con conseguente produzione di varie specie di ossigeno dannoso che danneggiano il tessuti del corallo.
Infatti, alcuni studi si discute del legame tra lo spessore del tessuto corallo e il danno causato da “livelli nocivi di ossigeno” correlati al moto d’acqua e alla fotosintesi, sulla quale è sicuramente da considerare anche effetto sinergico dell’alcalinità.
Riferimenti:
- Dana Riddle, 2016. How to Grow Corals Quicker: Effects of Various Alkalinity Concentrations on Rates of Zooxanthellae Photosynthesis. Advanced Aquarist
- Al-Moghrabi, S., C. Goiran, D. Allemand, N. Speziale, and J. Jaubert, 1996. Inorganic carbon uptake for photosynthesis by the symbiotic coral-dinoflagellate association. II. Mechanisms for bicarbonate uptake. J. Exp. Mar. Biol. Ecol., 199(2):227-248.
- Brading, P., M. Warner, D. Smith and D. Suggett, 2013. Contrasting modes of inorganic carbon acquisition amongst Symbiodinium (Dinophyceae) phylotypes. New Phytologist, 200(2):432-442.
- Comeau, S., P. J. Edmunds, N. B. Spindel, and R. C. Carpenter 2013b. The responses of eight coral reef calciers to increasing partial pressure of CO2 do not exhibit a tipping point. Limnol. Oceanogr. 58: 388-398.
- Finelli, C., B. Helmuth, N. Pentcheff, and D. Wethey, 2006. Water flow influences oxygen transport and photosynthetic efficiency in corals. Coral Reefs, 25: 47-57.
- Herfort, L., B. Thake, and I. Taubner. 2008. Bicarbonate stimulation of calcication and photosynthesis in two hermatypic corals. J. Phycol. 44: 91-98.
- Jury, C., R. Whitehead, and A. Szmant. 2010. Effects of variations in carbonate chemistry on the calcication rates of Madracis auretenra (Madracis mirabilis sensu Wells, 1973): Bicarbonate concentrations best predict calcication rates. Glob. Chang. Biol. 16: 1632-1644.
- Marubini, F. and B. Thake, 1999. Bicarbonate addition promotes coral growth. Limnol. Oceanogr., 44(3):716-720.
- Marubini, F. and M.J. Atkinson, 1999. Effects of lowered pH and elevated nitrate on coral calcification. Mar. Ecol. Prog. Ser., 188:117-121.
- Wall, C. and P. Edmunds, 2013. In situ effects of low pH and elevated HCO3- on juvenile massive Porites spp. in Moorea, French Polynesia. Biol. Bull. 225: 92-101.
- Zoccola, D., P. Ganot, A. Betucci, N. Caminiti-Segonds, N. Techer, C. Voolstra, M. Aranda, E. Tambutté, D. Allemand, J. Casey, and S. Tambutté, 2015. Bicarbonate transporters in corals point towards a key step in the evolution of cnidarian calcification. Scientific Reports 5, Article number: 9983.



